In Parkinsonsiekte sterf sekere senuweeselle in die brein. Pasiënte kan net stadiger word en hul spiere word styf. Arms en bene begin in vrede bewe. Baie pasiënte het ook probleme om te dink en raak dement. Lees hier: Wat is Parkinson presies? Wie word geraak? Hoe spreek hy homself uit? Watter behandelingsopsies is daar?

Parkinson: kort oorsig
- Tipiese simptome: Stadige bewegings, gebrek aan oefening, spierstyfheid, skud in rus, gebrek aan stabiliteit van die regop liggaamshouding, starwe gesigsuitdrukkings
- veroorsaak:Parkinson-siekte: sterf van dopamienproduserende selle in die brein; sekondêr aan Parkinson-siekte: ander afwykings, medisyne of bedwelmings; Genetiese Parkinson-sindroom: genetiese veranderinge
- Belangrike ondersoeke: Fisiese en neurologiese ondersoek, L-Dopa-toets, rekenaartomografie (CT), magnetiese resonansbeelding (MRI)
- Behandeling opsies: Medikasie (soos Levo-Dopa), fisioterapie, spraakterapie, arbeidsterapie, diepbreinstimulasie (THS)
Parkinson: simptome
Stywe spiere, vertraagde bewegings en bewende hande is tipiese kenmerke van Parkinson-siekte.
vroeë simptome van Parkinson se
Tekens van progressiewe breinsiekte kan jare voor die belangrikste simptome voorkom. Sulke vroeë simptome van die Parkinson is:
- REM Slaapgedragsversteuring: Normaal gesproke word ‘n persoon in droomslaap “verlam”. In die REM-slaapgedragsversteuring word die dromerige bewegings deels uitgevoer (praat, lag, gebare, ens.). Dit kan gevaarlik wees vir die persoon wat geraak word en die slaapmaat.
- Reukgevoel is verminder of heeltemal afwesig (hiposmie / anosmie)
- Pyn in spiere en gewrigte (dysestesie), dikwels in die omgewing van skouer en arm
- die arms swaai minder as jy loop
- Opstaan, was, aantrek, eet, ens. Neem langer as voorheen
- hardlywigheid
- Visuele versteurings (soos versteurde kleurvisie)
- die handskrif lyk beknop en word kleiner, veral aan die einde van ‘n reël of bladsy
- depressie
- Moegheid, uitputting
- stywe, onsekere gevoel, wankelrig
- die pasiënt onttrek en verwaarloos sy stokperdjies
Baie van hierdie vroeë simptome van die Parkinson is baie onspesifiek. U kan dus ook baie ander oorsake hê (soos die gevorderde ouderdom). Daarom word hulle dikwels nie as vroeë tekens van Parkinson erken nie.
REM slaap gedrag wanorde
Die belangrikste vroeë teken is die REM-slaapgedragsversteuring: diegene wat hierdie tipe slaapstoornis toon, het gewoonlik ‘n groter risiko vir sogenaamde neurodegeneratiewe siektes. Dit is progressiewe siektes wat die verlies van senuweeselle vergesel. Die meeste mense met ‘n REM-slaapstoornis ontwikkel later Parkinson-siekte. Ander word siek met ‘n sekere vorm van demensie (Lewy body demensie).
Parkinson: hoofsimptome
Die simptome van die Parkinson-siekte ontwikkel gewoonlik stadig. Familielede en vriende vang hulle dikwels vroeër as die pasiënt.
Die meeste simptome van Parkinson begin eensydig, dit wil sê aan slegs een kant van die liggaam. Later versprei hulle na die ander kant. Met die verloop van die siekte raak hulle ook meer prominent.
Die tipiese Parkinson-simptome is:
- vertraagde bewegings (bradykinesis) tot lae beweging (hipokinesis) of beweeglikheid (akinesia)
- stywe spiere (streng)
- Spiertrillings in rus (Parkinson se bewing)
- gebrek aan stabiliteit van regop postuur (posturale onstabiliteit)
Traag bewegings (bradykinesis): Alle liggaamsbewegings is onnatuurlik stadig. Dit beteken byvoorbeeld dat mense met Parkinson-siekte merkbaar traag is en in klein treetjies loop. Met verloop van tyd skuifel die gang, en pasiënte gaan vorentoe gebuig. Dit is een van die mees voor die hand liggende simptome. Parkinsonpasiënte kan ook stadig en met moeite gaan sit en weer opstaan. Soms word die aangetaste mense skielik in hul bewegings geblokkeer – dit wil voorkom asof hulle vries. Dit is wat mediese spesialiste ‘vries’ noem.
Die simptome van Parkinson-siekte beïnvloed ook die gebare en gesigsuitdrukkings: die gesig optree toenemend soos ‘n starre masker. Diegene wat geraak word, praat gewoonlik stil en eentonig, dus is dit moeiliker om te verstaan. As u sluk, veroorsaak dit gereeld probleme, soos om te drink of te eet. Nog ‘n simptoom van Parkinson is ‘n versteurde fynmotoriese vaardigheid: diegene wat geraak word, sukkel byvoorbeeld om iets te skryf, hul baadjie in te knoop of tande te borsel.
As die liggaamsbewegings besonder stadig is of die pasiënt gedeeltelik heeltemal roerloos is, praat dokters van akinesie (akinesia).
Styf spiere:In Parkinson is daar geen verlamming nie, maar die spierkrag word grotendeels behoue gebly. Die spiere is permanent gespanne, selfs in rus. Dit is pynlik vir diegene wat geraak word. Veral die skouer- en nekarea kan seermaak.
Die sogenaamde spierstyfheid kan aangetoon word Tandrat rigiditeit: As die dokter die arm van die pasiënt probeer beweeg, word dit deur die stywe spiere voorkom. Daarom kan die arm net ‘n bietjie beweeg en ruk. Dit voel amper asof daar ‘n rat in die gewrig is wat slegs die beweging na die volgende kerf laat beweeg en dan op sy plek klik. Die ratverskynsel word gewoonlik in die elmboog of pols getoets. Dit is ‘n tipiese Parkinson-siekte, maar dit kan ook by ander siektes voorkom.
Spiertrilling in rus (rus bewing): In Parkinson se siekte begin arms en bene gewoonlik rustig bewe. Daarom word die siekte ook ‘skud verlamming’ genoem. Die een kant van die liggaam word gewoonlik meer aangetas as die ander. Boonop bewe die arm gewoonlik meer as die been.
Parkinson se bewing kom kenmerkend voor by rus. Dit kan Parkinson onderskei van ander afwykings met bewing (bewing). As die hand byvoorbeeld nie in vrede bewe nie, maar sodra u ‘n doelgerigte beweging wil uitvoer, praat dokters van die sogenaamde opsetlike bewing. Die oorsaak daarvan is skade of versteuring in die serebellum.
Terloops, die meeste mense wat sidder, het nie Parkinson se siekte of enige ander herkenbare neurologiese afwyking nie. Die oorsaak van hierdie “noodsaaklike bewing” is onbekend.
Gebrek aan stabiliteit van regop liggaamshouding: Almal korrigeer onbewustelik sy liggaamshouding as hy te eniger tyd regop staan en staan. Die hele saak word beheer deur sogenaamde beheer en reflekse. Reflekse is outomatiese bewegings wat deur sekere stimuli veroorsaak word. Dit is onbewuste, onwillekeurige bewegings of spierspanning. Die hou- en verstellingsrefleks van die persoon is daarvoor verantwoordelik dat ‘n mens die liggaam outomaties kan balanseer selfs tydens beweging en nie val nie.
In Parkinson-siekte word die verstellings- en vashourefleks tipies versteur. Geaffekteerde persone sukkel dus om hul stabiliteit te handhaaf. Dit word posturale onstabiliteit genoem. Dit is die rede waarom die pasiënte van Parkinson nie meer skielik, onvoorsiene bewegings, soos ‘n trap of ‘n skielike windstoot, maklik meer kan “vang” nie. Daarom is hulle onseker as hulle maklik loop en val.
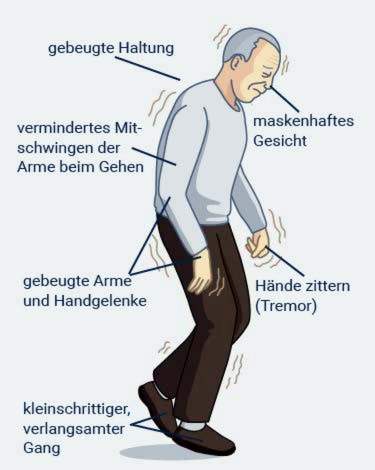
Parkinson: gepaardgaande simptome
Die belangrikste simptome van Main Parkinson gaan soms gepaard met ander klagtes:
Parkinsonpasiënte het meer gereeld een depressie as gesond en as mense met ander chroniese siektes. Soms ontwikkel die depressie slegs in die loop van Parkinson-siekte. By ander pasiënte is dit die motoriese simptome vooraf (die beweging vertraag, ens.).
Boonop in Parkinsonverlaag intellektuele kapasiteit en een demensie ontstaan (sien hieronder). Diegene wat geraak word, sukkel toenemend om te dink. ‘N Mens moet egter nie vergeet dat selfs die gesondste mense stadiger kan dink en dinge harder moet onthou soos hulle ouer word nie. Dit hoef dus nie noodwendig ‘n teken van Parkinson te wees nie.
In baie Parkinson-pasiënte produseer gesigsvel ‘n oormaat sebum. Dit lyk vetterig en blink. Dokters praat van sogenaamde “Olie gesig”: Die gesig van die pasiënt lyk asof die persoon ‘n dik laag salf of gesigroom aanwend.
Parkinson se simptome sluit ook blaasafwykings in: baie pasiënte kan nie hul blaas behoorlik beheer nie. So dit kan gebeur onwillekeurige urinering (inkontinensie) en die pasiënte self nat in die nag (Enurese). Die teendeel is ook moontlik: Sommige pasiënte het probleme om water te verlaat (urienretensie).
Die ingewande is dikwels traag in Parkinson, so kry ‘n hardlywigheid ontwikkel. Sulke hardlywigheid kan ook voorkom as ‘n vroeë teken van Parkinson.
Soms kom mans op sterkte probleme (Erektiele disfunksie). Hierdie impotensie kan veroorsaak word deur sowel die siekte self as deur die medisyne van Parkinson.
Al die gepaardgaande simptome kan ook veroorsaak word deur ander siektes, nie net Parkinson nie.
Parkinson se siekte
Parkinsonpasiënte is meer vatbaar vir demensie as die algemene bevolking: Ongeveer een derde van die pasiënte ontwikkel ook demensie gedurende die loop van die siekte. Volgens sommige studies is die risiko van Parkinson-demensie nog groter (tot 80 persent).
Die simptome van Parkinson-demensie is hoofsaaklik een versteurde aandag en een vertraagde denke, Dit is ‘n belangrike verskil aan Alzheimers – die algemeenste vorm van demensie. Alzheimer-pasiënte ly hoofsaaklik aan geheue-afwykings. In teenstelling hiermee kom die demensie van Parkinson eers voor in die latere stadiums van die siekte.
Lees meer in die artikel Dementia in Parkinson.
Parkinson: oorsake
Dokters diagnoseer ook Parkinson-siekte Primêre of idiopatiese Parkinson-siekte (IPS), “Idiopaties” beteken dat geen tasbare oorsaak vir die siekte gevind kan word nie. Hierdie “regte” Parkinson is ongeveer 75 persent van die Parkinson-sindrome. Hy staan in die fokus van hierdie teks. Om hiervan te onderskei, is die seldsame genetiese vorme van Parkinson-siektedat “sekondêre Parkinson-sindroom“en dit”Atipiese Parkinson-sindroomDit word hieronder kortliks beskryf.
Idiopatiese Parkinson: dopamienekort
Parkinson-siekte word veroorsaak deur ‘n spesifieke breinstreek, die sogenaamde ‘swart stof’ (substantia nigra) in die middelbrein. Hierdie breinstreek bevat baie yster en die kleurstof melanien. Albei kleur die ‘Substantia nigra’ opvallend donker (in vergelyking met die andersins helder breinweefsel).
In die “Substantia nigra” is spesiale senuweeselle wat die neurotransmitter dopamien produseer. Dopamien is baie belangrik om bewegings te beheer. In idiopatiese Parkinson sterf meer en meer dopamienproduserende neurone. Jy weet nie.
As gevolg van hierdie progressiewe seldood, daal die dopamienvlak in die brein steeds – dit ontwikkel dopamien tekort, Die liggaam kan dit lank balanseer: slegs wanneer ongeveer 60 persent van die dopamienproduserende senuweeselle dood is, word die dopamientekort opgemerk: Die pasiënt beweeg stadiger (bradykinese) of soms nie meer nie (akinesia).
Maar die dopamientekort is nie die enigste oorsaak van Parkinson-siekte nie; dit bring ook die sensitiewe by Saldo van neuro-oordragstowwe buite balans: Omdat minder en minder dopamien teenwoordig is, neem die hoeveelheid asetielcholien-boodskapper byvoorbeeld relatief toe. Volgens kenners is dit die oorsaak van bewing en styfheid in Parkinson-siekte.
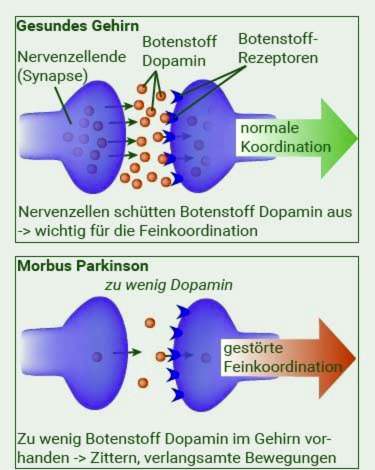
Die wanbalans van neuro-oordragstowwe in Parkinson kan ook verantwoordelik wees daarvoor dat baie pasiënte addisioneel depressief raak. Omdat ‘n mens weet dat die balans van die neuro-oordragstowwe in die algemeen gestoor word. Die verband tussen Parkinson-siekte en depressie is nog nie definitief opgelos nie.
Oorsake van Parkinson: Baie aannames, min bewyse
Waarom senuweeselle in die “substantia nigra” in Parkinson-siekte sterf, is nog onduidelik. Navorsing dui daarop dat verskeie faktore betrokke is by die ontwikkeling van Parkinson-siekte.
Wetenskaplikes het byvoorbeeld gevind dat senuweeselle by pasiënte met Parkinson slegs skadelike stowwe voldoende kan verwyder. Selbeskadigende stowwe is byvoorbeeld die sogenaamde “vrye radikale”. Dit is aggressiewe suurstofverbindings wat in verskillende metaboliese prosesse in die sel ontstaan.
Parkinson-senuweeselle sal moontlik nie hierdie gevaarlike stowwe kan afbreek voordat hulle skade berokken nie. Of die ontgiftingsvermoë van die selle is normaal, maar dit lewer ‘n buitensporige hoeveelheid “vrye radikale” in Parkinson. In albei gevalle kan die selbeskadigende stowwe in senuweeselle hulle ophoop en doodmaak.
Daar is ander moontlike oorsake van Parkinson wat tans bespreek en nagevors word.
Genetiese vorme van Parkinson
As ‘n familielid aan Parkinson-siekte ly, ontstel dit baie familielede. U wonder of Parkinson erflik is. In die oorgrote meerderheid van die gevalle is Parkinson egter die idiopatiese Parkinson-siekte hierbo beskryf. Erfenis is nie ‘n probleem in hierdie vorm van sporadiese siektes nie, meen kenners.
Dit verskil in die sogenaamde monogenetiese vorme van Parkinson: elkeen word veroorsaak deur die mutasie in ‘n spesifieke geen. Hierdie geenmutasies kan aan die nageslag oorgedra word. Monogene vorme van Parkinson is erflik. Dit word ook gereeld genoem familiale Parkinson-sindroom verwys. Gelukkig is dit skaars.
Sekondêre Parkinson-sindroom
In teenstelling met idiopatiese Parkinson, het simptomatiese (of sekondêre) Parkinson-sindroom duidelik identifiseerbare oorsake. Dit sluit in:
- Medisyne: Dopamien-remmers (dopamienantagoniste) soos neuroleptika (vir die behandeling van psigose) of metoklopramied (vir naarheid en braking), litium (vir depressie), valproïensuur (vir aanvalle), kalsiumantagoniste (vir hoë bloeddruk)
- ander siektes soos breingewasse, ontsteking van die brein (bv. as gevolg van VIGS), hipofunksie van die paratiroïedkliere (hipoparatiroïedisme) of Wilsonsiekte (kopersterktes)
- Vergiftiging, met mangaan of koolstofmonoksied
- Beserings van die brein
Atipiese Parkinson-sindroom
Atipiese Parkinson-sindroom ontwikkel as deel van verskillende neurodegeneratiewe siektes. Dit is siektes waarin neurone geleidelik in die brein sterf. In teenstelling met idiopatiese Parkinson-sindroom, beïnvloed hierdie seldood nie net die “substantia nigra” nie, maar ook ander breinstreke. Daarom is atipiese Parkinson-sindroom benewens Parkinsonagtige simptome nog meer simptome.
Neurodegeneratiewe siektes wat atipiese Parkinson-sindroom kan veroorsaak, sluit in:
- Lewy liggaam demensie
- Multisisteme atrofie (MSA)
- Progressiewe supranukleêre gestremdheid (PSP)
- Kortikobasale degenerasie
Sulke siektes het ‘n aansienlik erger prognose as die ‘regte’ (idiopatiese) Parkinson-sindroom.
Terloops, die middel “L-Dopa”, wat baie goed werk in idiopatiese Parkinson, help amper of glad nie met atipiese Parkinson nie.
Parkinson: behandeling
Parkinson se terapie word individueel aangepas vir elke pasiënt. Aangesien die simptome van siektes van persoon tot persoon kan verskil en dit met verskillende snelhede kan vorder.
Parkinson is meestal by dwelms soms is ligte simptome soms nie eers terapie nodig nie. Watter aktiewe bestanddele gebruik word, hang hoofsaaklik van die ouderdom van die pasiënt af. Soms kan ‘n neurochirurgiese prosedure nuttig wees – die sogenaamde Diep breinstimulasie (Deep Brain Stimulation, DBS).
Benewens mediese en moontlik chirurgiese maatreëls, kan die individuele Parkinson-behandeling ook ander boustene insluit. Dit sluit byvoorbeeld in fisioterapie, spraakterapie en Arbeidsterapie, Dit is in elk geval sinvol om in ‘n spesiale Parkinson-kliniek behandel te word.
Parkinson-terapie: medikasie
Daar is verskillende medisyne vir die behandeling van Parkinson. Dit help teen kwale soos stadige bewegings, stywe spiere en bewing. Hulle kan egter nie die dood van die senuweeselle en dus die vordering van die siekte voorkom nie.
Die tipiese Parkinson-simptome word veroorsaak deur ‘n gebrek aan dopamien in die brein. Dit kan dus verlig word deur die boodskapperstof as ‘n middel (byvoorbeeld in die vorm van L-Dopa) te verskaf, óf deur die afbreek van die bestaande dopamien (MAO-B-remmer, COMT-remmer) te stop. Albei meganismes vergoed vir dopamientekort. Dit skakel grootliks die tipiese Parkinson-simptome uit.
L-dopa (levodopa)
Parkinson se pasiënte om die ontbrekende dopamien direk as ‘n spuit of tablet toe te dien, het geen sin nie: die boodskapper word inderdaad deur die bloedstroom na die brein vervoer. Maar hy kan nie die beskermende bloed-breinversperring oorkom nie, en kom dus nie direk in die senuweeweefsel in nie. die Voorloper van dopamien maar is in staat om: Hierdie L-Dopa (levodopa) is dus geskik vir die behandeling van Parkinson. Wanneer dit die brein bereik, word dit deur die ensiem Dopa decarboxylase in dopamien omgeskakel. Dit kan dan die effek daarvan in die brein ontwikkel en Parkinson se simptome soos spierstyfheid (strengheid) verlig.
L-Dopa is baie effektiefen hetskaars newe-effekte, Dit word gewoonlik in die vorm van tablette, kapsules of druppels geneem. Dokters skryf dit veral voor by pasiënte ouer as 70 jaar. By jonger pasiënte word L-dopa egter net baie ingehou gebruik. Die rede is dat die behandeling met L-dopa na enkele jare bewegingsversteurings (dyskinesias) en effekskommelings (effekskommelings) kan veroorsaak (sien newe-effekte).
L-dopa word altyd gekombineer met ‘n ander aktiewe bestanddeel, die sogenaamde Dopa decarboxylase (soos benserazide of carbidopa). Dit verhoed dat L-dopa omgeskakel word na dopamien in die bloed, selfs voordat dit die brein bereik. Die dopa-dekarboksilase-remmer kan nie eers die bloed-breinversperring oorsteek nie. In die brein kan L-Dopa dus maklik omgeskakel word in dopamien.
Elke Parkinson-pasiënt reageer anders op L-Dopa. Daarom word die dosis afsonderlik bepaal: Die terapie word met ‘n lae dosis begin en dan geleidelik verhoog totdat die gewenste effek voorkom.
L-dopa moet meestal verskeie kere per dag geneem word. Dit moet altyd op dieselfde tye wees. Dit voorkom ‘n wisselende effek.
Dit is ook belangrik dat L-dopa minstens een uur voor of na ‘n proteïenryke maaltyd geneem word. Proteïenryke voedsel versteur die opname van die aktiewe bestanddeel in die bloed.
Newe-effekte:Parkinson-behandeling met L-dopa word oor die algemeen baie goed verdra, veral by lae dosisse. Veral aan die begin van die terapie naarheid voorkom. Dit kan goed gaan, maar as die aktiewe bestanddeel domperidon verlig. Aan die ander kant moet ander medisyne teen naarheid, soos metoklopramied, nie gebruik word nie: dit kruis ook die bloed-breinversperring en kan die gevolge van L-dopa neutraliseer.
Ander moontlike newe-effekte van L-Dopa is anorexia, duiseligheid, verhoogde dryfen depressie, Ouer mense reageer soms op behandeling met L-dopa hallusinasies, verwarring en kompulsiewe gedrag.Laasgenoemde manifesteer homself byvoorbeeld as ‘n verslawing aan dobbel- of koopverslaafdheid, as ‘n voortdurende drang na kos of seks of as kompulsiewe ordening van voorwerpe.
ook beweging versteurings (Dyskinesias) is moontlike newe-effekte van L-dopa: die pasiënte wat geraak word trek onwillekeurig aan of doen rukkende bewegingshulle kan nie voorkom nie. Hoe langer ‘n persoon met L-Dopa behandel word, hoe meer gereeld word ernstige bewegingsversteurings ervaar.
Langdurige behandeling met L-dopa kan ook veroorsaak dat die effek van die geneesmiddel fluktueer (effek skommelinge): Soms kan Parkinson-pasiënte glad nie beweeg nie (‘UIT-fase’), dan weer heeltemal normaal (‘AAN-fase’).
In sulke gevalle kan dit help Verander die doseringsskema van L-Dopa, Of anders kom die pasiënt aan vertraagde L-dopa-voorbereiding um: Die tablette met volgehoue vrystellings stel die aktiewe bestanddeel stadiger en oor ‘n langer periode vry as “normale” (nie-vertraagde) L-dopa-preparate. Die behandeling werk dan meer eweredig.
In die geval van skommelinge in L-Dopa (AAN-Fases) en / of bewegingsversteurings, kan die dokter die pasiënt ook ‘n draagbare gee dwelm pompGee: dit lei die levodopa outomaties via ‘n dun sonde direk in die duodenum in, waar dit in die bloed opgeneem word (duodenale sonde). Die aktiewe stof word dus voortdurend aan die pasiënt toegedien. Dit maak dit moontlik om baie eenvormige bloedvlakke in die bloed te bereik. Dit verminder die risiko van skommelinge in aktiwiteit en bewegingsversteurings. ‘N Duodenale ondersoek hou egter ook risiko’s in, byvoorbeeld vir peritonitis. Daarom word dit slegs in geselekteerde gevalle en deur ervare dokters gebruik.
‘N Alternatief vir pompterapie is diep breinstimulasie (sien hieronder).
dopamienagoniste
By pasiënte jonger as 70 jaar word die behandeling van Parkinson gewoonlik met sogenaamde dopamien-agoniste begin. Eers later vind die oorskakeling na die meer effektiewe L-Dopa plaas. Dus vertraag mens die voorkoms van bewegingsversteurings, aangesien dit veroorsaak word deur die langdurige gebruik van L-Dopa.
Dopamien-agoniste is chemies soortgelyk aan die boodskapperstof dopamien. Hulle steek maklik die bloed-breinversperring oor en dok op dieselfde bindingsplekke (reseptore) van senuweeselle as dopamien. Daarom het hulle ook ‘n soortgelyke effek.
Die meeste dopamien-agoniste wat in Parkinson-terapie gebruik word, word mondelings geneem (byvoorbeeld as ‘n tablet). Dit geld byvoorbeeld vir pramipexol, piribedil en ropinirol. Ander middels word as ‘n pleister met ‘n aktiewe bestanddeel (rotigotine) of as ‘n spuit of infusie (apomorfien) toegedien.
Newe-effekte: Dopamien-agoniste word minder goed verdra as L-dopa. Dit veroorsaak byvoorbeeld waterretensie in die weefsel (edeem), hardlywigheid, lomerigheid, duiseligheiden naarheid, Net soos L-Dopa, kan dopamienagoniste ook by ouer mense gebruik word hallusinasies, verwarring en kompulsiewe gedrag sneller.
Met langdurige gebruik kan dopamienagoniste ook effek variasies (Skommelinge met ON-OFF-fases) sneller. Maar dit gebeur baie minder gereeld as met L-Dopa. Die wisselende effek kan vergoed word deur die dosis van die dopamien-agoniste te verstel of die pasiënt van die tablette op ‘n dwelmlap (met rotigotien).
Daar is nog ‘n moontlikheid vir effekskommelings: die pasiënt ontvang bykomend tot die tablette Bespuit met apomorfien in die onderhuidse vetweefsel (onderhuid). Apomorfine kan vinnig die ongemak van Parkinson verlig, wat ondanks irritasie van die tablet irriterend is. Moontlike newe-effekte sluit in naarheid, braking, verhoogde of nuut voorkomende bewegingsversteurings (dyskinesie), duiseligheid, hallusinasies, ens.
As al hierdie pogings nie die skommelinge wat in werking tree, kan vergoed nie, kan die pasiënt ‘n draagbare medikasiepomp ontvang (apomorfien pomp). Oor ‘n dun buis en ‘n fyn naald lewer dit die aktiewe stof voortdurend aan die onderhuidse vetweefsel op die buik of dy (gewoonlik meer as 12 tot 18 uur).
Tot dusver ontbreek omvattende studies oor hierdie apomorfienpompterapie. Studies toon dat hulle die daaglikse OFF-fases (waarin die pasiënt amper nie kan beweeg nie) aansienlik kan verkort. Bewegingsversteurings (dyskinesias) kan ook verminder met die apomorfienpomp.
Moontlike newe-effekte is hoofsaaklik velreaksies op die inspuitplek van die naald, wat soms ernstig kan wees (pynlike rooiheid, Kötchenbildung, dood van weefsel = nekrose, ens.). Sommige pasiënte kla ook van naarheid, braking, bloedsomloopprobleme en hallusinasies.
MAO-B-inhibeerders
MAO-B-remmers (soos selegilien) rem die ensiem monoamienoksidase B (MAO-B), wat normaalweg dopamien afbreek. Op hierdie manier kan die vlak van dopamien in die brein van Parkinson-pasiënte verhoog word.
MAO-B-remmers is minder effektief as levodopa of dopamien-agoniste. As enigste Parkinson-behandeling is dit dus slegs geskik vir ligte simptome (gewoonlik in die vroeë stadiums van die siekte). Maar dit kan gekombineer word met ander medisyne van Parkinson (soos L-Dopa).
Newe-effekte: MAO-remmers word beskou as goed verdra. Dit het slegs ligte en omkeerbare newe-effekte. Dit sluit slaapstoornisse in, omdat die medisyne die drang verhoog. Daarom moet u vroeër die dag MAO-B-remmers neem. Dan word die slaap nie in die aand versteur nie.
COMT inhibeerders
COMT-remmers (soos entacapone) word saam met L-dopa voorgeskryf. Hulle blokkeer ook ‘n ensiem wat dopamien afbreek (die sogenaamde catechol O-methyl transferase = COMT). Op hierdie manier verleng COMT-remmers die effekte van dopamien.
Die aktiewe bestanddele word hoofsaaklik voorgeskryf om die fluktuasies in effek (skommelinge) onder behandeling met L-dopa te verminder. Hulle is dus medisyne vir gevorderde Parkinson-stadia.
Newe-effekte: COMT-remmers word gewoonlik goed verdra. Moontlike ongewenste gevolge sluit diarree, naarheid en braking in.
anticholinergiese
Die sogenaamde anticholinergika was die eerste middels wat vir Parkinson-terapie gebruik is. Hulle word nie so gereeld voorgeskryf nie.
As gevolg van die dopamienekort in Parkinson se ander boodskapperstowwe – in relatiewe terme – in oormaat. Dit geld byvoorbeeld asetielcholien. Dit veroorsaak onder meer die tipiese bewing (bewing) by die pasiënte. Dit kan met anticholinergika verlig word, omdat dit die werking van asetielcholien in die brein belemmer.
Newe-effekte: Anticholinergika kan ‘n verskeidenheid newe-effekte hê. Dit sluit in byvoorbeeld droë mond, droë oë, verminderde (selde verergerde) sweet, afwykings van die blaas, hardlywigheid, hartkloppings, fotosensitiewe oë, denkstoornisse en verwarring.
Veral ouer mense verdra anticholinergika dikwels nie goed nie. Daarom word die medisyne aan jonger pasiënte voorgeskryf.
NMDA antagoniste
Soos asetielcholien, is die boodskapper glutamaat in Parkinson in ‘n relatiewe oormaat teenwoordig as gevolg van dopamientekort. Daarteenoor help sogenaamde NMDA-antagoniste (amantadine, budipin). Dit blokkeer sekere dokkingsplekke van glutamaat in die brein en verminder sodoende die effek daarvan.
NMDA-antagoniste word in die vroeë stadiums van die primêre Parkinson-siekte gebruik.
Newe-effekte:Moontlike ongewenste gevolge van amantadien sluit in rusteloosheid, naarheid, verlies van eetlus, droë mond, retinale blouerige veranderinge (livedo reticularis), en verwarring en psigose (veral by bejaardes). Budipin kan gevaarlike hartaritmieë veroorsaak.
Deep Brain Stimulation (DBS)
Diepbreinstimulasie (THS) is ‘n chirurgiese prosedure in die brein. Dit word soms uitgevoer in idiopatiese Parkinson-sindroom. Die Engelse naam is “Deep Brain Stimulation” (DBS).
By diep breinstimulasie word klein elektrodes tydens chirurgie in sekere dele van die brein ingevoeg. Dit is bedoel om die patogene aktiwiteit van die senuweeselle positief te beïnvloed (óf te stimuleer of te inhibeer). Dus werk diepbreinstimulasie baie soos ‘n pasaangeër. Dit word soms ‘brein pasaangeër“(Al is hierdie term nie heeltemal korrek nie).
Diep breinstimulasie kom in aanmerking wanneer:
- kan nie skommelinge in aktiwiteit (skommelinge) en onwillekeurige bewegings (dyskinesie) met medikasie verlig nie
- die bewing (bewing) kan nie deur medikasie verwyder word nie.
Daarbenewens moet die pasiënt aan nog meer vereistes voldoen. Hy kan byvoorbeeld nie vroeë simptome van demensie toon nie. Sy algemene liggaamlike toestand moet goed wees. Boonop moet die parkinson-simptome (behalwe die bewing) op L-dopa reageer.
Ervaring het getoon dat die prosedure die simptome van baie pasiënte effektief kan verlig en hul lewensgehalte aansienlik kan verbeter. Die effek blyk op die langtermyn te bly. Dit beteken egter nie dat diep breinstimulering Parkinson kan genees nie – die siekte vorder selfs ná die prosedure.
By the way: Oorspronklik is diep breinstimulasie uitgevoer, veral in gevorderde Parkinson. Studies het egter getoon dat dit ook geskik is vir pasiënte onder die ouderdom van 60, vir wie L-Dopa-terapie slegs onlangs skommelinge in aktiwiteit getoon het en bewegingsversteurings veroorsaak.
Hoe werk die prosedure?
Diep breinstimulasie word in gespesialiseerde klinieke (THS-sentrums) uitgevoer. Voor die operasie is ‘n stewige metaalraam stewig aan die pasiënt se kop vasgemaak. Tydens die werklike werking is die raamwerk stewig aan die operasietafel gekoppel. Dit hou die kop heeltyd presies in dieselfde posisie. Dit is nodig om so presies moontlik met die mediese instrumente te kan werk (‘stereotaktiese breinoperasie’).
Nou word ‘n rekenaar-tomografie (CT) of magnetiese resonansbeelding (MRI) gemaak van die vasgeklemde raamkop. Mit dem Computer lässt sich genau errechnen, in welchem Winkel und in welcher Tiefe im Gehirn die Elektroden eingesetzt werden müssen, damit dann die Elektrodenspitzen am richtigen Ort liegen. Der “richtige Ort” ist in der Regel ein winziges Areal im Gehirn, der sogenannte Nucleus subthalamicus (NST).
Als Nächstes folgt die eigentliche Operation: Der Neurochirurg bohrt mit einem speziellen Bohrer zwei kleine Löcher in die Schädeldecke, um darüber die winzigen Elektroden einzuführen. Das klingt brachial, ist aber für den Patienten nicht mit Schmerzen verbunden. Er ist während der gesamten Operation wach. Das ist nötig, damit der Chirurg die richtige Platzierung der Elektroden in einem Test überprüfen kann.
Am nächsten Tag wird unter Vollnarkose der Impulsgeber unter die Haut am Schlüsselbein oder am Oberbauch implantiert. Über kleine Kabel wird er mit den Elektroden im Gehirn verbunden. Die Kabel verlaufen unter der Haut.
Der Impulsgeber gibt kontinuierlich Strom an die Elektroden ab. Je nach Stromfrequenz werden dadurch die Areale an den Enden der Elektroden stimuliert oder gehemmt. So lindert sofort die motorischen Hauptsymptome der Parkinson-Erkrankung, also verlangsamte Bewegung, Muskelsteifheit und Zittern. Bei Bedarf lässt sich die Stromfrequenz mit einer Fernbedienung nachjustieren.
Sollte der Eingriff nicht den erwünschten Effekt haben, können die Elektroden wieder entfernt oder der Impulsgeber abgeschaltet werden.
Mögliche Komplikationen und Nebenwirkungen
Generell gilt: Die Tiefe Hirnstimulation scheint bei Patienten vor dem 50. Lebensjahr erfolgreicher zu sein und seltener Komplikationen zu verursachen als bei älteren Menschen.
Die wichtigste Komplikation, die sich durch die Hirnoperation selbst ergeben kann, sind Blutungen im Schädel (intrakranielle Blutungen). Außerdem kann das Einsetzen des Impulsgebers und der Kabel eine infeksie sneller. Dann muss meist das System vorübergehend herausgenommen und der Patient mit Antibiotika behandelt werden.
Bei fast jedem Patienten kommt es nach dem Eingriff, wenn das System noch eingestellt wird, zu vorübergehenden Nebenwirkungen. Das können zum Beispiel parestesie (Parästhesien) sein. Diese treten aber oft nur direkt nach dem Einschalten des Impulsgebers auf und verschwinden dann wieder.
Weitere meist vorübergehende Effekte sind zum Beispiel verwarring, gesteigerter Antrieb, abgeflachte Stimmungen Teilnahmslosigkeit (Apathie). Manchmal treten auch sogenannte Impulskontrollstörungen op. Dazu zählt zum Beispiel ein gesteigertes sexuelles Verlangen (Hypersexualität). Bei einigen Patienten löst die Tiefe Hirnstimulation auch leichte Sprechstörungen, een Störung der Bewegungskoordination (Ataxie), duiseligheid asook Gang- und Standunsicherheituit.
Verdere terapie metodes
Verschiedene Behandlungskonzepte können Parkinson-Patienten zusätzlich helfen, dass sie möglichst lange ihre Beweglichkeit, Sprechfähigkeit und Selbstständigkeit im Alltag bewahren. Die wichtigsten Verfahren sind:
Physiotherapie: Die Physiotherapie umfasst viele verschiedene Techniken. Die Patienten können zum Beispiel mit geeigneten Übungen ihr Gleichgewicht und ihre Sicherheit beim Gehen trainieren. Sinnvoll sind auch Kraft- und Dehnungsübungen. Die Schnelligkeit und der Rhythmus der Bewegungen lassen sich ebenfalls gezielt trainieren.
Logopädie: Viele Patienten entwickeln im Laufe der Parkinsonerkrankung eine Sprechstörung. Sie sprechen zum Beispiel auffallend monoton und sehr leise oder erleben wiederholt Blockaden beim Sprechen. Eine logopädische Therapie kann hier helfen.
Ergotherapie:Die Ergotherapie hat zum Ziel, dass die Parkinsonpatienten in ihrer persönlichen Umwelt möglichst lange selbstständig bleiben. Dafür passt man zum Beispiel den Wohnraum so an, dass der Patient sich besser zurechtfindet. Außerdem werden Stolperfallen wie Teppiche entfernt. Der Ergotherapeut entwickelt zusammen mit den Betroffenen auch Strategien, wie sich der Alltag mit der Erkrankung besser bewältigen lässt. So zeigt er den Patienten zum Beispiel den Umgang mit Hilfsmitteln wie Strumpfanzieher oder Knöpfhilfe. Zusätzlich berät der Therapeut die Angehörigen, wie sie den Parkinson-Patienten im Alltag sinnvoll unterstützen können.
Behandeling van comorbiditeite
Das Parkinson-Syndrom betrifft oft ältere Menschen. Diese leiden meist zusätzlich noch an anderen Erkrankungen wie Bluthochdruck, Herzschwäche (Herzinsuffizienz), erhöhten Blutfettwerten oder Diabetes. Diese Begleiterkrankungen müssen ebenfalls fachgerecht behandelt werden. Das wirkt sich positiv auf die Lebensqualität und Lebenserwartung der Patienten aus.
Parkinson-Therapie: Was können Sie selbst tun?
Wie bei den meisten chronischen Beschwerden und Erkrankungen gilt auch für Parkinson: Betroffene sollten sich aktiv mit ihrer Erkrankung auseinandersetzen und sich über Ursachen und Behandlungsmöglichkeiten informieren. Denn in vielen Fällen ist es die Angst vor dem Ungewissen, welche die Patienten besonders belastet. Je mehr man über die Erkrankung erfährt, desto eher verschwindet das Gefühl der Machtlosigkeit gegenüber dem fortschreitenden Parkinson.
Heilbar ist die Erkrankung derzeit leider nicht. Mit der richtigen Behandlung ist für viele Patienten aber ein weitgehend normales Leben möglich.
Was Sie selbst zu einer wirksamen Therapie beitragen können, lesen Sie hier:
» Gehen Sie offen mit Ihrer Erkrankung um. Vielen Menschen mit Parkinson fällt es zunächst sehr schwer, die Erkrankung zu akzeptieren und offen damit umzugehen. Stattdessen versuchen sie, die Symptome zu verstecken. So setzt man sich selbst aber unter unnötigen Druck. Wenn Sie offen mit Freunden, Angehörigen und Arbeitskollegen über Ihre Erkrankung sprechen, wird Ihnen das eine gewaltige Last von den Schultern nehmen.
» Informieren Sie sich über die Krankheit. Je mehr Sie über Parkinson wissen, desto weniger unheimlich erscheint er Ihnen vielleicht. Auch als Angehöriger eines Parkinson-Patienten sollten sie sich über die Erkrankung informieren. So können Sie Ihren Angehörigen wirksam und sinnvoll unterstützen.
» Schließen Sie sich einer Parkinson-Selbsthilfegruppe an. Wer sich regelmäßig mit anderen Betroffenen austauschen kann, kommt oft besser mit der Erkrankung zurecht.
» Bleiben Sie fit. Sie können einen guten Allgemeinzustand bewahren, werden Sie körperlich aktiv bleiben. Dazu genügen schon regelmäßige Bewegung (wie Spaziergänge) und leichter Ausdauersport. Die Angehörigen können den Patienten dabei unterstützen.
» Kleine Hilfen im Alltag. Viele Parkinson-Symptome erschweren des Alltag. Dazu zählt etwa das sogenannte “Einfrieren” (Freezing) – der Betreffende kann sich dabei nicht mehr bewegen. Hier helfen visuelle Reize auf dem Boden, beispielsweise aufgeklebte Fußabdrücke, oder akustische Rhythmusgeber (“Links, zwo, drei, vier”). Wichtig für Mitmenschen: Es macht keinen Sinn, den Patienten zur Eile zu drängen oder zu ziehen. Dies verlängert die “Einfrier”-Episode eher.
» Gesunde Ernährung. Menschen mit Parkinson essen und trinken oft zu wenig, weil sie ungeschickt und langsam sind. Manche möchten auch den anstrengenden Toilettengang möglichst vermeiden. Für einen gesunden Allgemeinzustand ist es aber sehr wichtig, dass man ausreichend Flüssigkeit (etwa zwei Liter am Tag) zu sich nimmt und sich ausgewogen ernährt.
Parkinson: Fachkliniken
Menschen mit dem Parkinson-Syndrom sollten nach Möglichkeit in einer Fachklinik behandelt werden. Ärzte und sonstige Mitarbeiter dort sind auf die Erkrankung spezialisiert.
Mittlerweile gibt es in Deutschland zahlreiche Kliniken, die eine Akutbehandlung und/oder Rehabilitation für Parkinson-Patienten anbieten. Einige davon tragen ein Zertifikat der Deutsche Parkinson Vereinigung (dPV). Es wird an Krankenhäuser und Rehabilitationseinrichtungen verliehen, die spezielle diagnostische und therapeutische Angebote für Menschen mit Parkinson und verwandte Erkrankungen haben. Das Zertifikat der dPV wird den Spezial-Kliniken für drei Jahre verliehen. Auf Wunsch der jeweiligen Einrichtung kann es nach erneuter Prüfung jeweils für weitere drei Jahre verlängert werden.
Eine ausgewählte Liste von Spezialkliniken für Parkinson-Patienten finden Sie im Beitrag Parkinson – Klinik.
Parkinson: Untersuchungen und Diagnose
Wenn Sie den Verdacht einer Parkinson-Erkrankung bei sich selbst oder einem Angehörigen haben, ist der Besuch bei einem fachkundign Arzt ratsam. Der Spezialist für Erkrankungen des Nervensystems ist der Neurologe, Am besten gehen Sie zu einem Neurologen, der auf die Diagnose und Behandlung von Parkinson spezialisiert ist. An manchen neurologischen Kliniken gibt es auch eigene Sprechstunden beziehungsweise Ambulanzen für Parkinson-Patienten.
Arzt-Patient-Gespräch
Beim ersten Besuch wird der Neurologe im Gespräch mit Ihnen beziehungsweise dem betroffenen Angehörigen die Krankengeschichte erheben (geval geskiedenis). Für die Parkinson-Diagnose ist dieses Gespräch enorm wichtig: Wenn der Patient seine Beschwerden ausführlich schildert, kann der Arzt einschätzen, ob es sich tatsächlich um Parkinson handeln könnte. Mögliche Fragen des Arztes sind zum Beispiel:
- Seit wann ungefähr besteht das Zittern (Tremor) der Hände/Beine?
- Haben Sie das Gefühl, dass Ihre Muskulatur ständig angespannt ist?
- Haben Sie Schmerzen, etwa im Schulter- oder Nackenbereich?
- Fällt es Ihnen schwer, beim Gehen das Gleichgewicht zu halten?
- Fallen Ihnen feinmotorische Tätigkeiten (zum Beispiel ein Hemd zuknöpfen, Schreiben) zunehmend schwer?
- Haben Sie Probleme beim Schlafen?
- Ist Ihnen aufgefallen, dass sich Ihr Geruchssinn verschlechtert hat?
- Wurde bereits bei Angehörigen eine Parkinson-Erkrankung festgestellt?
- Nehmen Sie Medikamente ein, beispielsweise aufgrund psychischer Probleme? (Antipsychotika, „Dopaminantagonisten“ wie Metoclopramid)
Körperliche und neurologische Untersuchung
Neben dem Anamnesegespräch folgen eine körperliche und eine neurologische Untersuchung. Dabei überprüft der Arzt allgemein die Funktion des Nervensystems: Er testet zum Beispiel die Reflexe des Patienten, die Empfindsamkeit (Sensibilität) der Haut und die Beweglichkeit der Muskeln und Gelenke. Dabei achtet er besonders auf die Hauptsymptome von Parkinson:
Verlangsamte Bewegungen (Bradykinese) sind sehr charakteristisch für Parkinson. Der Arzt erkennt sie, indem er Ihren Gang, Ihre Gestik und Mimik beobachtet. Möglicherweise wird er Sie bitten, einige Meter im Untersuchungsraum entlang zu gehen. Dabei kann er auch beurteilen, ob Sie „wackelig auf den Beinen“ sind (posturale Instabilität).
Um festzustellen, ob Ihre Muskeln auffallend steif sind (Rigor), wird der Arzt prüfen, ob sich Ihre Gelenke flüssig bewegen lassen. Bei Parkinson ist die Muskelspannung stark erhöht, so dass die Muskeln einen Widerstand entgegensetzen, wenn der Arzt versucht, ein Gelenk (wie den Ellenbogen) zu bewegen. Dieses Phänomen wird auch als Zahnradphänomen bezeichnet (siehe oben: “Parkinson: Symptome”).
Ob bei Ihnen ein Zittern in Ruhe (Ruhetremor) vorliegt, bemerkt der Arzt während der körperlichen Untersuchung. Wichtig für die Parkinson-Diagnose ist die Unterscheidung zwischen einem Ruhetremor (wie er bei Parkinson auftritt) und anderen Tremorarten. Dazu zählt zum Beispiel der sogenannte Intentionstremor: Bei einer Schädigung im Kleinhirn beginnt die Hand zu zittern, sobald der Betreffende versucht, eine gezielte Bewegung damit auszuführen. In Ruhe zittert die Hand dagegen nicht.
Parkinson-Test (L-Dopa-Test)
Um die Parkinson-Diagnose zu unterstützen, wird manchmal der sogenannte L-Dopa-Test durchgeführt. Dabei erhalten Patienten einmalig die Dopamin-Vorstufe L-Dopa (Levodopa). Das ist jenes Medikament, das zur Standardtherapie bei Parkinson gehört. Bei manchen Patienten bessern sich die Bewegungsstörungen und die steifen Muskeln schon kurz nach der Einnahme (ungefähr eine halbe Stunde danach). Dann liegt vermutlich ein idiopathisches Parkinson-Syndrom vor (Achtung: Der Ruhe-Tremor lässt sich nicht immer mit Levodopa lindern).
Der L-Dopa-Test ist in der Parkinson-Diagnostik aber nur begrenzt aussagekräftig. Denn manche Menschen haben zwar Parkinson, sprechen aber nicht auf den Test an. Dann fällt das Ergebnis falsch-negativ aus. Umgekehrt kann der L-Dopa-Test auch bei anderen Erkrankungen als Parkinson positiv ausfallen. Das gilt zum Beispiel bei manchen (aber nicht allen) Patienten mit einer sogenannten Multisystematrophie. Bei dieser fortschreitenden Erkrankung sterben Nervenzellen in verschiedenen Hirnregionen ab. Das kann ein atypisches Parkinson-Syndrom auslösen.
Wegen dieser Probleme wird der L-Dopa-Test nicht routinemäßig in der Parkinson-Diagnostik empfohlen. Ein weiterer Grund dafür ist, dass er Nebenwirkungen wie Übelkeit und Erbrechen haben kann. Um diesen vorzubeugen, erhalten Patienten vor dem Test in der Regel das Anti-Brechmittel Domperidon.
Der L-Dopa-Test kann auch helfen, die Therapie bei Parkinson zu planen: Bei nachgewiesenem Parkinson kann mit dem Test geprüft werden, wie gut der Patient auf L-Dopa anspricht. Aber auch hier darf man kein eindeutiges Testergebnis erwarten. Manche Patienten sprechen nicht auf den Test an (negatives Ergebnis), lassen sich später aber trotzdem gut mit L-Dopa behandeln.
By the way: Anstelle des L-Dopa-Tests wird zur Parkinson-Diagnose gelegentlich der Apomorphin-Test gemacht. Hier wird geprüft, ob sich die Bewegungsstörungen nach einer Apomorphin-Spritze bessern. Wenn ja, spricht dies für ein idiopathisches Parkinon-Syndrom. Es gilt hier aber das Gleiche wie beim L-Dopa-Test: Nicht bei jedem Parkinson-Patient fällt der Test positiv aus. Zudem können Nebenwirkungen wie Übelkeit, Erbrechen oder Schläfrigkeit auftreten.
Prosedures vir beeldvorming
Mithilfe der Computertomografie (CT) oder der Kernspintomografie (MRT) lässt sich das Gehirn des Patienten bildlich darstellen. Das kann helfen, andere mögliche Ursachen für die vermuteten Parkinson-Symptome auszuschließen, beispielsweise einen Hirntumor. Die Bildgebung des Gehirns hilft also, ein idiopathisches Parkinson-Syndrom von einem sekundären Parkinson oder anderen neurodegenerativen Erkrankungen (wie atypischer Parkinson) zu unterscheiden.
Eventuell werden dazu auch spezielle Untersuchungen durchgeführt. Dazu gehört beispielsweise die SPECT (Single Photon Emission Computed Tomography), eine nuklearmedizinische Untersuchung: Dem Patienten wird dabei zuerst eine radioaktive Substanz verabreicht. Mit dieser lassen sich jene Nervenenden im Gehirn darstellen, die sich bei Parkinson zurückbilden (DAT-SPECT). Das kann Aufschluss in unklaren Fällen geben.
Wenn die Parkinson-Diagnose unklar ist, ordnet der Arzt manchmal auch eine spezielle Variante der Positronen-Emissions-Tomografie (PET) an: die FDG-PET, Die Abkürzung FDG steht für Fluordesoxyglukose. Das ist ein radioaktiv markierter Einfachzucker. Er wird dem Patienten verabreicht, bevor man das Gehirn bildlich mittels PET darstellt. Diese Untersuchung kann vor allem helfen, ein atypisches Parkinson-Syndrom abzuklären. Allerdings ist die Untersuchung zu diesem Zwecke nicht offiziell zugelassen. Sie wird deshalb nur in begründeten Einzelfällen dazu eingesetzt (“off-label-use”).
Weniger aufwändig und kostengünstiger als diese Spezialuntersuchungen ist die Ultraschalluntersuchung des Gehirns (Transkranielle Sonografie, TCS). Sie hilft, ein idiopathisches Parkinson-Syndrom im Frühstadium zu erkennen und gegen andere Erkrankungen (wie atypische Parkinson-Syndrome) abzugrenzen. Dazu sollte der Arzt mit dieser Untersuchung aber umfassende Erfahrungen besitzen. Anderenfalls kann er das Untersuchungsergebnis vielleicht nicht richtig interpretieren.
Wie wird letztlich die Parkinson-Diagnose gestellt?
Es ist nach wie vor oft schwer, die Diagnose Parkinson zweifelsfrei zu stellen. Ein Grund dafür ist, dass es viele verschiedene Erkrankungen gibt, die ähnliche Symptome wie die Parkinson-Erkrankung auslösen.
Das Arzt-Patient-Gespräch (Anamnesegespräch) und die körperlich-neurologische Untersuchung sind essenziell für die Parkinson-Diagnostik. Die weiteren Untersuchungen dienen in erster Linie dazu, andere Gründe für die Symptome auszuschließen. Nur wenn sich die Beschwerden gut durch Parkinson erklären lassen und keine anderen Ursachen dafür gefunden werden, kann die Parkinson-Diagnose (Idiopathisches Parkinson-Syndrom) gestellt werden.
Sonderfall: Genetisch bedingter Parkinson
Wie im Abschnitt “Ursachen” erwähnt, sind genetisch bedingte Formen von Parkinson sehr selten. Sie lassen sich aber mit einer molekulargenetischen Untersuchung feststellen. Eine solche Untersuchung kommt in Betracht, wenn:
- der Patient vor dem 45. Lebensjahr an Parkinson erkrankt oder
- mindestens zwei Verwandte 1. Grades an Parkinson leiden.
In diesen Fällen liegt der Verdacht nahe, dass die Parkinson-Erkrankung durch eine Genmutation verursacht wird.
Gesunde Angehörige eines Patienten mit genetisch bedingtem Parkinson können sich ebenfalls einem Gentest unterziehen. So lässt sich feststellen, ob auch sie die auslösende Genmutation aufweisen. Ein solcher Gentest zur Abschätzung des persönlichen Parkinson-Risikos darf aber erst durchgeführt werden, nachdem der Betreffene von einem Facharzt ausführlich genetisch beraten wurde.
Siekteverloop en prognose
Das idiopathische Parkinson-Syndrom ist eine fortschreitende Erkrankung, die bislang nicht heilbar ist. Je nach Symptomatik unterscheiden Mediziner vier Verlaufsformen:
- akinetisch-rigider Typ: Es treten vor allem Bewegungslosigkeit und Muskelsteife auf, während Tremor kaum oder gar nicht vorhanden ist.
- Tremordominanz-Typ: Das Hauptsymptom ist das Zittern (Tremor).
- Äquivalenz-Typ: Bewegungslosigkeit, Muskelsteife und Zittern sind ungefähr gleich ausgeprägt.
- monosymptomatischer Ruhe-Tremor: Das Zittern in Ruhe ist das einzige Symptom. Sehr seltene Verlaufsform.
Neben der Verlaufsform spielt das Erkrankungsalter eine wichtige Rolle bei Parkinson: Verlauf und Prognose werden davon beeinflusst, ob die Erkrankung in verhältnismäßig jungem Lebensalter (beispielsweise ab dem 40. Lebensjahr) oder aber im höheren Alter ausbricht.
So passiert es bei jüngeren Patienten viel eher, dass die Parkinson-Medikamente Bewegungsstörungen (Dyskinesien) und Wirkungsschwankungen (Fluktuationen) auslösen. Das trifft besonders beim akinetisch-rigiden Parkinson-Typ zu, für den ein frühes Erkrankungsalter typisch ist. Dafür ist L-Dopa bei diesen Patienten gut wirksam.
Anders beim Tremordominanz-Typ: Die Betroffenen sprechen relativ schlecht auf L-Dopa an. Dafür schreitet bei ihnen der Parkinson langsamer voran als bei den anderen Verlaufsformen. Somit hat der Tremordominaz-Typ die günstigste Prognose.
Parkinson: Lebenserwartung
Mitte der 1970er Jahre wurden moderne Parkinson-Medikamente wie Levodopa entwickelt. Das veränderte die Prognose bei “echtem” (idiopathischem) Parkinson: Lebenserwartung und Lebensqualität der Patienten verbesserten sich dank der neuen Wirkstoffe. Laut Statistik hat ein optimal behandelter Parkinson-Patient heute fast die gleiche Lebenserwartung wie eine gleichaltrige gesunde Person: Wenn heute jemand mit 63 Jahren die Diagnose Parkinson bekommt, kann er schätzungsweise noch mit weiteren 20 Lebensjahren rechnen. Zum Vergleich: Mitte des letzten Jahrhunderts lebten Patienten nach der Diagnose im Schnitt noch etwas mehr als neun Jahre.
Die gestiegene Lebenserwartung beim idiopathischen Parkinson-Syndrom kommt dadurch zustande, dass die modernen Medikamente die wesentlichen Beschwerden der Patienten weitgehend beheben. Früher führten solche Beschwerden oft zu Komplikationen, die dann den Patienten vorzeitig sterben ließen. Ein Beispiel: Parkinson-Patienten, die sich kaum noch bewegen konnten (Akinesie), waren oft bettlägerig. Diese Bettlägerigkeit lässt das Risiko für gefährliche Erkrankungen wie Thrombose oder Lungenentzündung massiv ansteigen.
Die verbesserte Lebenserwartung, wie sie hier beschrieben ist, bezieht sich nur auf das idiopathische Parkinson-Syndrom (= den „klassischen Parkinson“). Atypische Parkinson-Syndrome, bei denen die Betroffenen nicht oder kaum auf eine Behandlung mit L-Dopa ansprechen, schreiten meist rascher voran. Sie haben in der Regel eine deutlich schlechtere Prognose.
Verdere inligting
Boek aanbevelings:
- Parkinson – das Übungsbuch: Aktiv bleiben mit Bewegungs-Übungen (Elmar Trutt, 2017, TRIAS)
- Parkinson: Ein Ratgeber für Betroffene und Angehörige (Willibald Gerschlager, 2017, Facultas / Maudrich)
riglyne:
- S3-Leitlinie “Idiopathisches Parkinson-Syndrom” der Deutschen Gesellschaft für Neurologie (Stand: 2016)
Ondersteuningsgroepe:
Deutsche Parkinson Vereinigung e.V.:
https://www.parkinson-vereinigung.de